
В структуре назначений антибактериальных препаратов в амбулаторной практике одно из ведущих мест занимает хроническая обструктивная болезнь легких (ХОБЛ). Примерно половина случаев обострений ХОБЛ непосредственно связана с инфекцией и требует назначения антибиотиков. В плацебо–контролируемых исследованиях, проведенных в 70–80–х годах прошлого столетия, установлено, что антибиотики приводят к более быстрому исчезновению симптомов обострения, сокращают сроки выздоровления и увеличивают длительность межрецидивного периода [1,2].
Для лечения инфекционных обострений ХОБЛ применяются антибиотики разных классов. В 60–80–х годах XX века широко применялись тетрациклины (тетрациклин, доксициклин), сульфаниламиды, ко–тримоксазол, ампициллин, хлорамфеникол, в меньшей степени – природные макролидные антибиотики. В последние 20 лет обычно рекомендуются три класса антибактериальных препаратов:
• b–лактамы – амоксициллин, амоксициллин/клавуланат, пероральные цефалоспорины II поколения (цефуроксим аксетил, цефаклор);
• полусинтетические макролиды – кларитромицин и азитромицин;
• фторхинолоны, преимущественно препараты нового поколения – левофлоксацин, моксифлоксацин, гатифлоксацин, гемифлоксацин.
Указанные антибиотики обычно приводятся в большинстве Практических рекомендаций по лечению обострений ХОБЛ (в частности, в европейских рекомендациях ERS/ESCMID) [3].
Вызывает удивление факт отсутствия в Практических рекомендациях по лечению обострений ХОБЛ пероральных цефалоспоринов III поколения, в частности, цефиксима. Эти антибиотики по своим антимикробным свойствам не уступают ингибитор–защищенным пенициллинам и цефалоспоринам II поколения, и их применение при ХОБЛ представляется более обоснованным, чем макролидов. Далее будет предпринята попытка обосновать целесообразность включения цефиксима в рекомендации по лечению обострений ХОБЛ.
Выбор антибактериального препарата для лечения внебольничных респираторных инфекций обычно основывается на трех главных критериях:
• природная активность антибиотика in vitro против основных возбудителей заболевания;
• уровень приобретенной резистентности возбудителей в популяции;
• доказанная клиническая эффективность антибиотика в контролируемых сравнительных исследованиях.
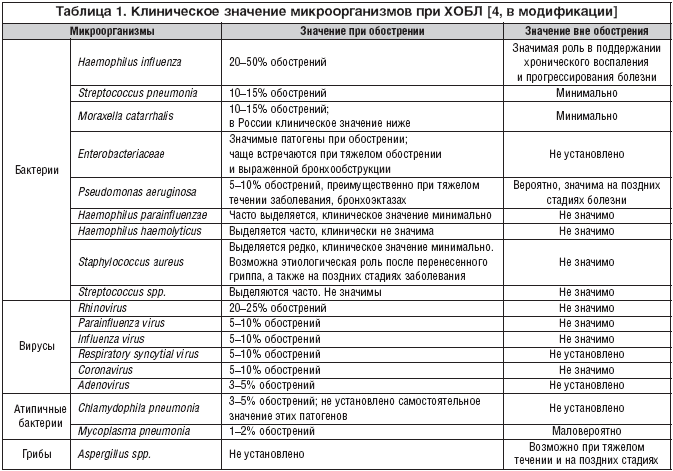
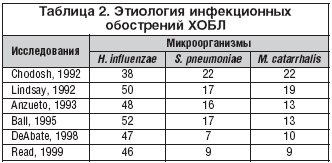
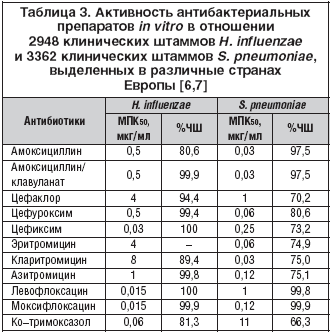
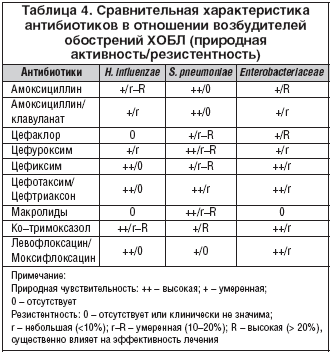
В этиологии инфекционного обострения ХОБЛ могут принимать участие различные бактерии и вирусы (табл. 1), но важнейшее значение имеют два микроорганизма – H. influenzae и S. pneumoniae, на долю которых в сумме приходится 60–80% случаев обострений [4,5]. В большинстве исследований, проведенных в 90–х годах прошлого века, приводятся данные о доминирующей роли этих двух микроорганизмов, причем ведущее место занимает гемофильная палочка, ответственная за половину случаев обострений ХОБЛ (табл. 2). Поэтому в антимикробном спектре антибиотиков для лечения инфекционных обострений ХОБЛ наиболее важным является их активность против этих двух микроорганизмов, а также частота устойчивых штаммов в популяции. Наиболее репрезентативные обобщенные данные по чувствительности внебольничных респираторных патогенов в настоящее время представлены в многоцентровом исследовании PROTECT [6,7]. Активность антибиотиков в отношении H. influenzae и S. pneumoniae представлена в таблице 3.
Haemophilus influenzae
Наиболее выраженной активностью in vitro в отношении гемофильной палочки обладают цефиксим (напр., Супракс «Гедеон Рихтер») и антипневмококковые фторхинолоны; чувствительность микроорганизма к амоксициллину, амоксициллин/клавуланату, цефуроксиму существенно ниже. Активность макролидых антибиотиков против H. influenzae крайне низкая, а цефаклор вообще клинически значимой активностью не обладает. Однако если практически все штаммы гемофильной палочки проявляют хорошую чувствительность к амоксициллин/клавуланату, цефиксиму и фторхинолонам, то к азитромицину есть штаммы, проявляющие высокий уровень устойчивости со значением МПК (минимально подавляющая концентрация) >16 мг/л.
Согласно критериям CLSI большинство штаммов H. influenzae (>90%) чувствительны к азитромицину и кларитромицину (критерии чувствительности для эритромицина не разработаны). Однако уровень активности всех макролидов против H. influenzae очень невысокий; в частности, значения МПК90 для эритромицина и кларитромицина составляют 8 мг/л, для азитромицина ниже – 2 мг/л (критерий чувствительности CLSI для азитромицина – 4 мг/л и ниже, для кларитромицина – 8 мг/л и ниже) [8]. В любом случае даже максимальные концентрации эритромицина, кларитромицина и азитромицина в крови (соответственно 2,5, 2,0 и 0,5) не достигают значений МПК90 для H. influenzae, что не позволяет ожидать надежного клинического эффекта. Концентрации макролидных антибиотиков в тканях бронхолегочной системы обычно превышают их концентрации в крови, однако следует учитывать факт уменьшения активности этих препаратов против H. influenzae при снижении рН, что наблюдается при воспалительных процессах в верхних и нижних отделах дыхательных путей (особенно при гнойных процессах). Фармакодинамическое моделирование и клинические исследования показывают крайне малую вероятность достижения эрадикации гемофильной палочки при лечении макролидными антибиотиками. На основании этих данных Европейское агентство по лабораторным стандартам EUCAST с 2010 года рассматривает H. influenzae, как природно устойчивую к макролидным антибиотикам.
Таким образом, наиболее высокой активностью против H. influenzae обладают цефиксим и антипневмококковые фторхинолоны.
Streptococcus pneumoniae
Наиболее высокой природной активностью против пневмококков обладают аминопенициллины, цефуроксим и макролидные антибиотики, активность цефиксима и антипневмококковых фторхинолонов ниже.
В последние годы наблюдается снижение чувствительности пневмококков ко многим антибактериальным средствам. По данным исследования PROTECT [7], наибольшая чувствительность пневмококков сохраняется к новым фторхинолонам и амоксициллину.
Наряду с устойчивостью к пенициллину, отмечается рост устойчивых штаммов S. pneumoniae к эритромицину и другим макролидным антибиотикам, причем устойчивость к последним возрастает как среди пенициллинчувствительных, так и пенициллинрезистентных штаммов пневмококка. Большинство пенициллинрезистентных штаммов пневмококка также устойчивы к макролидам. Устойчивость S. pneumoniae к 14– и 15–членным макролидам перекрестная, то есть если микроорганизм устойчив к эритромицину, то с высокой вероятностью он будет устойчив и к кларитромицину, и к азитромицину. Сходный уровень устойчивости пневмококков наблюдается к пероральным цефалоспоринам II–III поколений.
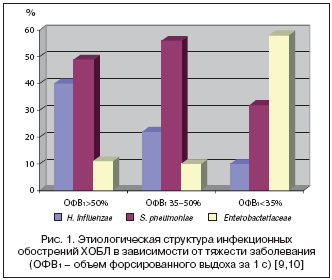
Следует отметить, что этиологическая структура обострений ХОБЛ в значительной степени зависит от тяжести обострения и выраженности бронхиальной обструкции. Так, в ряде исследований было показано, что при нетяжелых обострениях доминируют H. influenzae и S. pneumoniae, при более тяжелых обострениях и выраженной бронхообструкции существенно возрастает этиологическая роль энтеробактерий, прежде всего E. coli, Klebsiella pneumoniae (рис. 1) [9,10]. Таким образом, при более тяжелых обострениях ХОБЛ антибиотик должен обладать высокой активностью против грамотрицательных бактерий, не только H. influenzae, но также Enterobacteriaceae. Наибольшей активностью против энтеробактерий среди цефалоспоринов обладает препарат III поколения цефиксим, среди других антибиотиков – фторхинолоны; активность амоксициллин/клавуланата существенно ниже.
Сравнительные данные по природной активности антибиотиков против основных возбудителей обострений ХОБЛ и приобретенной устойчивости в популяции представлены в таблице 4.
Приведенные данные наглядно показывают: активность цефиксима против наиболее актуальных возбудителей обострений ХОБЛ не уступает амоксициллин/клавуланату, а по некоторым позициям превосходит, особенно при более тяжелом течении обострении ХОБЛ и возрастании роли энтеробактерий. Также из таблицы 4 видно, что по активности в отношении ведущих возбудителей обострений ХОБЛ цефиксим сходен с антипневмококковыми фторхинолонами и парентеральными цефалоспоринами III поколения. Фармакодинамическое моделирование показывает эквивалентность и прогнозируемую равную эффективность цефтриаксона в дозе 1 г и цефиксима в дозе 400 мг при лечении обострений ХОБЛ [11].
Эффективность цефиксима при лечении инфекционных обострений ХОБЛ документирована в многочисленных рандомизированных сравнительных и несравнительных исследованиях. В двойном слепом исследовании у 222 пациентов с обострением ХОБЛ было показано, что цефиксим при коротком курсе 5 дней не уступает по эффективности 10–дневному курсу терапии [12]. Сходные результаты продемонстрированы также в мета–анализе [13].
Цефиксим показал одинаковую бактериологическую эффективность с ципрофлоксацином при лечении обострений хронического бронхита (78 и 81%), а также с амоксициллин/клавуланатом (82%) [14].
Во всех исследованиях цефиксим не уступал (или превосходил) препаратам сравнения в эрадикации H. influenzae. В то же время скорость эрадикации S. pneumoniae из бронхов на фоне цефиксима была ниже по сравнению с цефуроксим аксетилом [15], что логически следует из данных о природной антипневмококковой активности сравниваемых антибиотиков (табл. 3).
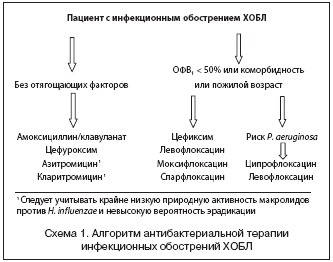
На основании приведенных данных и аргументов можно сделать вывод о целесообразности включения перорального цефалоспорина III поколения цефиксима (напр., Супракс «Гедеон Рихтер») в рекомендации по антибактериальной терапии инфекционных обострений ХОБЛ, особенно у пожилых, при выраженной бронхиальной обструкции или наличии сопутствующих заболеваний. Место цефиксима в лечении обострений ХОБЛ показано на схеме 1.
Литература
1. Anthonisen NR, Manfreda J, Warren CP, et al. Ann Intern Med 1987; 106:196–204
2. Saint S, Bent S, Vittinghoff E, et al. JAMA 1995; 273:957–60
3. Woodhead M, Blasi F, Ewig S, et al. Eur Respir J 2005;26:1138–80
4. Sethi S, Murphy TF. New Engl J Med 2008;359(22):2355–65
5. Brunton S, Carmichael BP, Colgan R. Amer J Managed Care 2004;10(10):689–96
6. Hoban D, Felmingham D. J Antimicrob Chemother 2002; 50 (Suppl 1):49–59.
7. Felmingham D, Reinert RR, Hirakata Y, Rodloff A. J Antimicrob Chemother 2002; 50 (Suppl 1):25–37.
8. Schito GC, Mannelli S, Pesce A, and the Alexander Project Group. J Chemother 1997; 9 (Suppl 3): 18–28.
9. Miravitlles M, Espinosa C, Fernandez–Laso E, et al. Chest 1999;116(1):40–6.
10. Eller J, Ede A, Schaberg T, Niederman MS, Mauch H, Lode H. Chest 1998;113(6):1542–8.
11. Owens RC et al. Int J Antimicrob Agents 2001;17(6):483–9
12. Lorenz J, Steinfeld P, Drath L, et al. Clin Drug Investig 1998;15(1):13–20
13. Falagas ME, Avgeri SG, Matthaiou DK, Dimopoulos G, Siempos II. J Antimicrob Chemother 2008;62(3):442–50
14. Cazzola M, Vinsiguerra A, Beghi G, et al. J Chemother 1995;7(5):432–41
15. Zuck P, Petitpretz P, Geslin P, et al. Int J Clin Pract 1999;53(6):437–43
Яковлев С.В.
РМЖ

 Опубликовано в категории:
Опубликовано в категории:  Метки:
Метки: